Chữa trị vết thương hở là một vấn đề rất quan trọng, nếu không xử lý đúng cách có thể gây ra những hậu quả xấu đối với sức khỏe. Quá trình chữa lành vết thương có tính chất phức tạp, liên quan đến nhiều quy trình vật lý, hóa học và sinh học. Chữa lành vết thương cũng liên quan đến những tương tác phức tạp giữa các tế bào, các thành phần của ma trận ngoại bào và các con đường truyền tín hiệu sinh hóa [1, 2]. Với những đặc tính lý hóa đặc biệt và những tính chất có thể kiểm soát được, vật liệu nano đã tạo ra các cơ hội nghiên cứu mới trong lĩnh vực chữa lành vết thương. Sử dụng vật liệu nano trong liệu pháp chữa trị vết thương có thể khắc phục những nhược điểm của phương pháp chăm sóc vết thương truyền thống và nâng cao hiệu quả chữa lành [3].
Những quá trình sinh học tinh vi của cơ thể sẽ tham gia vào việc chữa lành vết thương nhằm mục đích phục hồi tính toàn vẹn và chức năng của mô [4]. Tuy nhiên, một số yếu tố như vết thương dai dẳng, sự nhiễm trùng, việc tái tạo mô chậm và đóng miệng vết thương kém có thể cản trở việc chữa lành và gây ra những tác động tiêu cực đến cơ thể [5, 6]. Thực tế đó nảy sinh nhu cầu ngày càng tăng về các phương pháp điều trị mới có thể giải quyết các vấn đề này [7]. Công nghệ nano với nhiều thành tựu đáng kể trong những năm gần đây có triển vọng to lớn cho một loạt ứng dụng trong y học, trong đó có chữa lành vết thương [8].
Tính cách mạng khi sử dụng vật liệu nano điều trị vết thương
Vật liệu nano có những lợi ích cụ thể có thể cách mạng hóa việc điều trị vết thương nhờ các đặc tính lý hóa đặc biệt và kích thước hạt ở thang nano [9]. Vật liệu có khả năng kiểm soát các quá trình sinh học ở cấp độ tế bào và cấp độ phân tử do sở hữu các đặc tính bề mặt tùy chỉnh, tỷ lệ bề mặt trên thể tích cao và một số đặc tính riêng khác. Vật liệu nano do vậy đã thu hút được nhiều sự quan tâm như những công cụ linh hoạt để phát triển các phương pháp điều trị, chữa lành vết thương tiên tiến; có thể kể đến một số tác dụng cụ thể của vật liệu nano trong lĩnh vực này như tạo ra những cơ hội mới để cải thiện việc chăm sóc vết thương, tái tạo mô tốt hơn, kiểm soát nhiễm trùng, kiểm soát thuốc có mục tiêu và giảm sẹo [10-13].
Để tối ưu hóa quá trình chữa lành vết thương, vật liệu nano có thể cung cấp các nền tảng đa chức năng kết hợp các đặc tính kháng khuẩn, kéo dài thời gian giải phóng thuốc và truyền tín hiệu đến các phân tử hoạt tính sinh học [14]. Chúng cũng có thể bắt chước ma trận ngoại bào (extra cellular matrix – ECM), thúc đẩy sự kết dính, tăng sinh và di chuyển của tế bào cũng như sửa đổi các con đường truyền tín hiệu liên quan đến tái tạo mô [15]. Tiềm năng của một số loại vật liệu nano trong ứng dụng chữa lành vết thương đã được nghiên cứu: các vật liệu nano kim loại như nano bạc, nano vàng, nano kẽm oxit thể hiện hoạt tính kháng khuẩn đặc biệt chống lại nhiều chủng mầm bệnh, giúp ngăn ngừa nhiễm trùng và đẩy nhanh việc làm lành vết thương [16, 17]; các vật liệu nano polyme như hydrogel, sợi nano đóng vai trò là bộ khủng hoàn hảo cho sự kết dính, di chuyển, tăng sinh tế bào, thúc đẩy tái tạo mô [18]; việc cung cấp thuốc được điều chỉnh tại chỗ có thể thực hiện được nhờ các vật liệu nano gốc lipid như liposome và các hạt nano lipid rắn đảm bảo giải phóng thuốc điều trị kéo dài tại vị trí vết thương [19]; các vật liệu nano vô cơ khác như nano canxi phosphat, nano silica mang tới khả năng thúc đẩy sự hình thành mạch máu mới, lắng đọng ma trận ngoại bào và tăng sinh tế bào, thúc đẩy tái tạo mô và chữa lành vết thương [20].
Các phương pháp điều trị chữa lành vết thương dựa trên vật liệu nano có tương lai tươi sáng, nhưng vẫn còn một số trở ngại nhất định cần khắc phục, đặc biệt là các vấn đề liên quan đến an toàn, độc tính của vật liệu nano, những tác động tiêu cực tiềm ẩn, tính ổn định lâu dài và các yếu tố điều chỉnh [21]. Để thiết lập tính khả thi của các phương pháp điều trị chữa lành vết thương dựa trên vật liệu nano cho các ứng dụng lâm sàng, cũng cần phải đánh giá hiệu quả về chi phí và khả năng mở rộng sản xuất [22].
Nguyên lý chữa lành vết thương hở
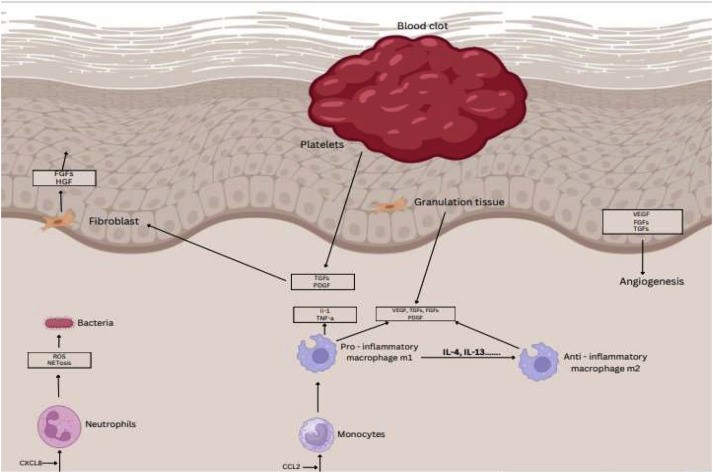
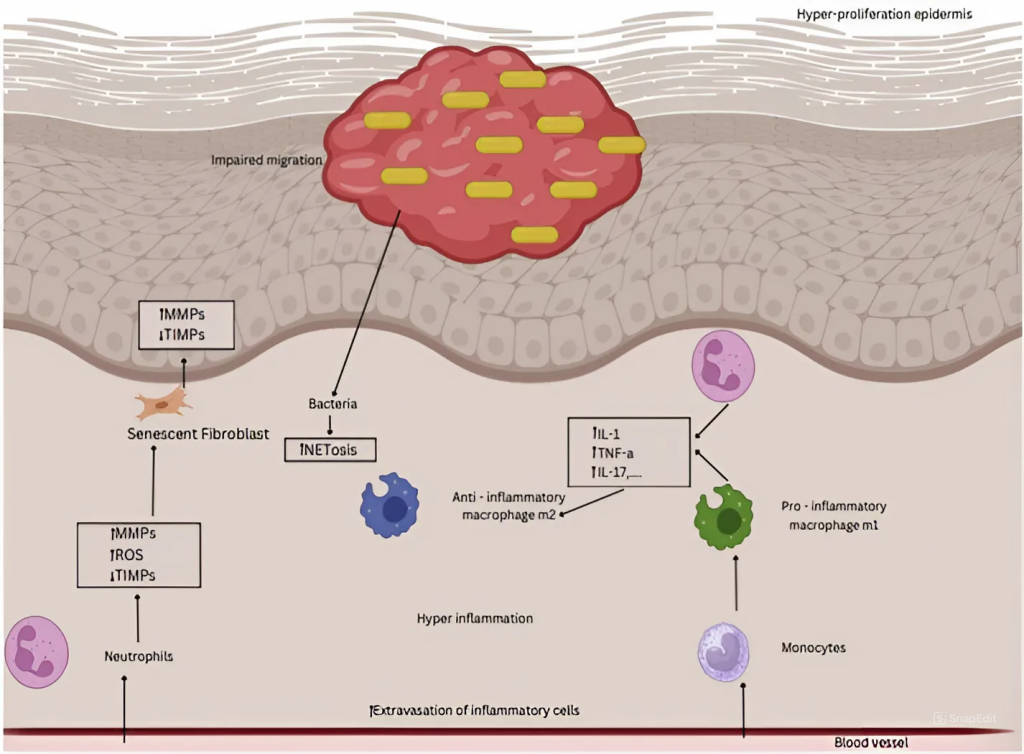
Phục hồi vết thương hở là một quá trình rất phức tạp và có nhiều thách thức. Việc phục hồi hàng rào biểu bì có hiệu quả cao ở những người khỏe mạnh (Hình 1) [23]. Sau khi da bị thương, cơ thể sẽ khởi động một loạt phản ứng sinh hóa có kiểm soát để chữa lành vết thương: đầu tiên là giai đoạn cầm máu; sau đó là giai đoạn viêm; đến giai đoạn tăng sinh bao gồm tái tạo biểu mô, tạo mô hạt và tân mạch; cuối cùng là giai đoạn tái tạo da [24]. Tuy nhiên, sự hiện diện của nhiều tình trạng cụ thể có thể làm tăng tần suất chậm lành vết thương, ví dụ hoạt động nguyên phân kém, tăng các chất trung gian gây viêm như cytokine (nhóm protein đa chức năng, được sản xuất bởi các tế bào miễn dịch giúp cơ thể vận hành hệ miễn dịch) và enzym protease (bao gồm enzym elastase), hoạt động kém của các yếu tố tăng trưởng nhỏ và về cơ bản là các nguyên bào sợi già cỗi đều là những đặc điểm của vết thương mãn tính (Hình 2) [25]. Nhiều nghiên cứu đã chỉ ra sự xơ hóa vết thương tỷ lệ thuận với mức độ nghiêm trọng của tình trạng viêm. Do đó, cần lưu ý khả năng phi thường của thai nhi trong việc phục hồi vết thương không để lại sẹo được hỗ trợ bởi tình trạng không bị viêm trong tử cung [26]. Tương tự như vết thương mãn tính, tình trạng viêm dai dẳng được đặc trưng bởi sự thâm nhiễm bạch cầu trung tính quá mức và sự gia tăng lượng các gốc oxy hóa hoạt động (reactive oxygen species – ROS) do mất hoạt động thực bào của đại thực bào. Mặc dù các ROS đóng vai trò quan trọng trong việc bảo vệ chống lại vi khuẩn có hại, nhưng việc chứa quá nhiều ROS trong vết thương có thể làm tăng sự căng thẳng oxy hóa và dẫn đến tổn thương mô đồng thời sản xuất quá mức enzym metalloproteinase (MMP). Trong khi đó, mối quan hệ chính xác giữa tình trạng viêm dai dẳng và vết thương hở dễ bị nhiễm trùng vẫn chưa rõ ràng [27]. Bằng chứng từ các vết thương mãn tính cho thấy mức MMP tăng cao gây ra sự phân hủy quá mức các thành phần ma trận ngoại bào (Extracellular matrix – ECM) và cản trở quá trình di chuyển của tế bào. Phản ứng không đầy đủ của nguyên bào sợi đối với các yếu tố tăng trưởng có liên quan đến sự phân hủy ECM, từ đó góp phần gây ra mô hạt bị khiếm khuyết [28]. Các màng sinh học, dù là đơn vi khuẩn hay đa vi khuẩn, đều gây thêm một lớp khó khăn nữa cho quá trình chữa lành vết thương bằng cách tạo ra các enzym protease có khả năng ngăn chặn tế bào sừng di chuyển và ngăn da tái tạo biểu mô [29]. Các vi sinh vật ban đầu bám vào bề mặt; tuy nhiên sau khi bám vào, chúng có thể được loại bỏ và vẫn có thể điều trị được bằng kháng sinh [30]; chúng phát triển thành một màng sinh học không thể bị ngăn chặn bởi kháng sinh hoặc hệ thống miễn dịch vì chúng bám vào bề mặt và bắt đầu giải phóng một ma trận mucopolysaccharide (các mạch phân tử đường có kích thước lớn, gọi là polysaccharide nhầy) được tạo thành từ các bộ phận của vi khuẩn và vật chủ. Ở rìa vết thương mãn tính, các tế bào sừng tăng sinh quá mức nhưng không thể di chuyển vì chúng chưa được hoạt hóa và biệt hóa hoàn toàn [31]. Khi sử dụng liều cao các cytokine tiền viêm (IL-1 và TNF-β) để tạo ra phản ứng nguyên bào sợi, sản xuất MMP sẽ tăng lên và tiết chất ức chế mô của ma trận enzym metalloproteinase sẽ giảm xuống [19]. Các vòng fibrin được tạo thành từ fibrin và protein huyết tương, bao quanh các mạch máu nhỏ, gây ra tình trạng thiếu oxy kéo dài, giảm cung cấp vi chất dinh dưỡng và gây thêm tổn thương mô [27].
Trong thời gian gần đây, sự phát triển nhanh chóng trong ứng dụng vật liệu nano để chữa lành vết thương đã thúc đẩy việc khám phá lâm sàng các phương pháp điều trị chữa lành vết thương dựa trên liệu pháp nano [32-34]; có thể phân loại các phương pháp điều trị đó thành thành các phương pháp dùng vật liệu nano vô cơ và phương pháp dùng vật liệu nano hữu cơ.
Chữa lành vết thương sử dụng vật liệu nano vô cơ
Khi so sánh với các phương pháp thông thường, việc sử dụng các hạt nano làm từ kim loại và oxit kim loại để điều trị vết thương có hiệu quả tốt hơn. Bản chất của các loại vật liệu này là có đặc tính kháng khuẩn, và đo đó có khả năng chữa lành vết thương. Hiệu quả của các hạt nano vô cơ trong các ứng dụng sinh học thường bị ảnh hưởng bởi sự chức năng hóa bề mặt, thế zeta, kích thước, hình dạng, độ ổn định thủy phân và độ xốp của chúng. Các hạt nano vô cơ được nghiên cứu nhiều nhất là vàng, bạc và oxit kẽm.
i. Nano bạc
Nano bạc (Ag-NP) thường được dùng để điều trị vết thương nhiễm trùng. Trên thực tế, bạc đã được dùng để điều trị vết thương từ thiên niên kỷ thứ 2 trước công nguyên ở thời của các Pharaon Ai Cập. Các đặc tính chữa lành vết thương của bạc cũng được ghi nhận trong sách giáo khoa y khoa của Hippocrates – người nổi tiếng với “Lời thề Hippocrates”. Các nhà nghiên cứu ngày càng quan tâm đến việc sử dụng Ag-NP trong nhiều ứng dụng y tế khác nhau trong vài năm gần đây cũng nhờ khả năng kháng khuẩn của nó, ví dụ trong việc băng vết thương, cấy ghép nhân tạo ngăn ngừa nhiễm trùng và thúc đẩy chữa lành vết thương. Ngoài ra, sử dụng băng chứa Ag-NP không dẫn đến bất kỳ tác dụng phụ nào ngay cả trong thời gian dài. Vì thế, các sản phẩm băng vết thương chứa Ag-NP hiện có sẵn trên thị trường.
Điểm quan trọng cần biết là diện tích bề mặt được tăng cường và kích thước của hạt nano trong Ag-NP, vì đó là các yếu tố quyết định đến tác dụng kháng khuẩn của nó. Các đặc điểm lý hóa học này cho phép Ag-NP đi qua màng tế bào và gây tổn thương nội bào vi khuẩn, ngăn ngừa sự phát triển của vi khuẩn. Các nghiên cứu đã chứng minh rằng hạt nano bạc với các polyme sinh học không gây độc tế bào và được công nhận rộng rãi là vật liệu nano sinh học hiệp đồng an toàn để băng vết thương. Ngoài việc ngăn chặn nhiễm trùng thêm, chúng còn giúp vết thương mau lành hơn. Nano bạc với polyme sinh học được coi là then chốt để điều trị các vết thương mãn tính. Việc sử dụng đồng thời Ag-NP với nhiều vật liệu khác như chitosan, tinh bột, collagen, cellulose và axit hyaluronic để chữa lành vết thương đã được chứng minh cả trong môi trường ống nghiệm và trên cơ thể sống.
ii. Nano vàng
Nano vàng (Au-NP) là loại vật liệu nano phổ biến khác được sử dụng trong y tế. Chúng có hiệu quả trong nhiều bối cảnh y sinh, bao gồm chữa lành vết thương, tái tạo mô và phân phối có mục tiêu. Để cải thiện hiệu quả kháng khuẩn và chữa lành vết thương, các đặc tính cộng hưởng plasmon bề mặt của Au-NP có thể được tinh chỉnh (Cộng hưởng Plasmon bề mặt – SPR, là quá trình phát hiện bằng quang học xảy ra khi ánh sáng phân cực đi vào lăng kính được phủ lớp kim loại vàng mỏng). Bằng cách bám vào chuỗi DNA của vi khuẩn, quá trình tháo xoắn của chuỗi xoắn kép này sẽ bị ngăn chặn trong quá trình sao chép và phiên mã, các hạt Au-NP sẽ kìm hãm sự phát triển của các tác nhân gây bệnh như pseudomonas aeruginosa (trực khuẩn mủ xanh) và staphylococcus aureus (tụ cầu vàng).
Au-NP cũng có khả năng cản trở quá trình chuyển hóa năng lượng của vi khuẩn bằng cách thâm nhập vào tế bào vi khuẩn và thay đổi điện thế màng (sự khác biệt về điện thế giữa bên trong và bên ngoài của một tế bào sinh học) vi khuẩn. Nó cũng chặn đứng sự hoạt động của enzym ATP synthase trong vi khuẩn và tiêu diệt mọi vi khuẩn sót lại. Ngoài ra, Au-NP hoạt động như chất chống oxy hóa để đẩy nhanh quá trình chữa lành vết thương và ngăn vi khuẩn sản xuất các loại oxy phản ứng. Collagen, gelatin và chitosan đều có thể được hưởng lợi từ việc kết hợp Au-NP và liên kết chéo sau đó. Tính tương thích sinh học và khả năng phân hủy sinh học chỉ là hai trong số những lợi ích mà quá trình chức năng hóa Au-NP mang lại.
iii. Nano oxit kẽm
Nhờ tính an toàn sinh học, khả năng tương thích sinh học và khả năng kháng khuẩn, vật liệu nano oxit kẽm (ZnO-NP) đã được ứng dụng rộng rãi trong các ngành công nghiệp mỹ phẩm và sản phẩm điều trị. Các nghiên cứu trước đây chỉ ra rằng kích thước của các hạt ZnO-NP rất quan trọng trong việc loại bỏ một số vi sinh vật có hại. Ví dụ, các hạt ZnO-NP có kích thước 8nm đã ngăn chặn được sự phát triển của chủng tụ cầu vàng RN6390 (dù vậy, các hạt ZnO-NP có kích thước 5-7nm lại có tác dụng thấp hơn).
Nhờ kích thước giảm, nhiều hạt nano kẽm oxit hơn có thể được lắng đọng trên bề mặt vi khuẩn, nơi chúng tích tụ trong tế bào chất và màng tế bào để tiêu diệt vi khuẩn. Một lượng lớn các loại oxy phản ứng hay gốc oxy hóa hoạt động (Reactive oxygen species – ROS) được tạo ra bởi các dung dịch nước của các hạt ZnO-NP có năng lực kháng khuẩn mạnh. Tiếp xúc trực tiếp và sản xuất ROS đáng kể với các hạt ZnO-NP cũng được phát hiện là có khả năng gây tử vong cao đối với các mầm bệnh mycobacterium. ZnO-NP cũng có thể ức chế sự hình thành màng sinh học của trực khuẩn mủ xanh và tụ cầu vàng phụ thuộc vào liều lượng. ZnO-NP nhúng trong chitosan hydrogel, băng collagen hoặc tấm cellulose đã được các nghiên cứu chứng minh là có hiệu quả trong việc giảm khả năng nhiễm trùng trong quá trình chữa lành vết thương hở.
Ngoài ra, có thể kể đến các vật liệu nano vô cơ có các tác dụng hỗ trợ trong điều trị vết thương hở dưới nhiều cách thức khác nhau như: nano đồng (Cu-NP), nano titan dioxit (TiO2-NP), nano oxit sắt (FeO-NP), nano gốm (Ceramic-NP), v.v., các loại vật liệu nano cacbon như ống nano cacbon, graphene và fullerene, v.v.
Chữa lành vết thương sử dụng vật liệu nano hữu cơ
i. Nano lipid
Nano lipid, giống như nhiều loại vật liệu nano kim loại, là thành phần quan trọng trong việc cung cấp thuốc để chữa lành vết thương do kích thước nhỏ, diện tích bề mặt lớn và khả năng tải thuốc cao. Những đặc tính này cho phép chúng bao bọc và cung cấp hiệu quả các tác nhân điều trị đến các vùng mục tiêu. Nano lipid cũng có thể được chức năng hóa bằng các phối tử hoặc kháng thể cụ thể để tăng cường khả năng nhắm hướng mục tiêu để đảm bảo được truyền dẫn chính xác đến vị trí tác động mong muốn. Kích thước nhỏ của nó thúc đẩy quá trình chữa lành nhanh hơn và hiệu quả hơn, có thể được thiết kế để giải phóng các tác nhân điều trị theo cách có kiểm soát, giảm thiểu tác dụng phụ và tối đa hóa lợi ích điều trị, v.v.
Dược phẩm, hormone tăng trưởng và siRNA (Small interfering RNA – RNA tiểu can thiệp) đều có thể tìm thấy hệ thống phân phối phù hợp trong hạt nano lipid. Các chất mang hiệu quả để chăm sóc vết thương đã được phát triển từ hai loại nano lipid là nano lipid rắn (Solid Lipid Nanoparticle – SLN) và chất mang nano lipid (Nanostructured Lipid Carrier – NLC). Các chất mang này vận chuyển các thành phần tương thích sinh học có tác dụng bảo vệ dược phẩm khỏi sự phân hủy và kéo dài quá trình giải phóng thuốc. Khi so sánh với các công cụ phân phối truyền thống, SLN và NLC tỏ ra có hiệu quả vượt trội. Do kích thước nhỏ bé, chúng có thể khuếch tán trong màng sinh học, đưa thuốc đến gần hơn với các tế bào vi khuẩn cần xử lý.
ii. Nano polyme
Tầm quan trọng của nano polyme tương thích sinh học đã được nêu bật trong y sinh học và kỹ thuật sinh học. Hầu hết các vật liệu nano polyme được chế tạo từ axit polylactic-co-glycolic (PLGA), alginate, chitosan, gelatin và các sự kết hợp polyme khác. Khi nói đến việc vận chuyển các phân tử sinh học như DNA, hormone tăng trưởng và kháng sinh, các vật liệu nano polyme cũng có nhiều ưu điểm vượt trội. Trong khi các yếu tố tăng trưởng (như yếu tố tăng trưởng nguyên bào sợi-2 – Fibroblast growth factor 2 (FGF2); và yếu tố tăng trưởng biểu bì – Epidermal growth factor (EGF)) là cần thiết để vết thương lành thành công, thì thời gian bán hủy của chúng bị rút ngắn đáng kể bởi các enzym phân giải protein (như metalloproteinase ma trận – MMP) có trong môi trường vi mô của vết thương. May mắn là hoạt tính sinh học và sự giải phóng các yếu tố tăng trưởng này có thể được duy trì nhờ vào quá trình bao bọc bên trong các hạt vật liệu nano polyme. Việc kết hợp các tác nhân kháng khuẩn vào các vật liệu nano polyme cho đến nay là chủ đề nóng của nhiều nghiên cứu.
iii. Nanobiotic
Nanobiotic, hay các hạt nano chứa kháng sinh, là một bước ngoặt trong việc điều trị vết thương do vi khuẩn kháng thuốc gây nên. Hoạt động trong ống nghiệm của các vật liệu nano biến đổi vancomycin có phổ rộng. Các kháng sinh gắn vào các hạt nano polyacrylate và các hạt nano poly(butyl acrylate-styrene) với beta-lactam N-thiolated có tác dụng tốt đối với chủng khuẩn tụ cầu vàng kháng methicillin (methicillin-resistant staphylococcus aureus – MRSA) – loại vi khuẩn có thể gây nhiễm trùng đe dọa tính mạng ở các bộ phận khác nhau của cơ thể với độc tính thấp hơn nhiều. Hydrogel poly(-glutamic acid)/gelatin được tạo thành từ gelatin, chitosan, các hạt nano epigallocatechin gallate (EGCG) và gentamicin (một loại kháng sinh phổ rộng được sử dụng rộng rãi trong điều trị các nhiễm khuẩn nặng) không dính vào vị trí vết thương, giúp tái tạo biểu mô trong ống nghiệm và trong cơ thể sống, đồng thời dễ dàng được loại bỏ khỏi vị trí vết thương [8]. Sự nhũ tương kép của quá trình bay hơi được sử dụng trong tổng hợp các hạt nano poly(acid lactic-co-glycolic) (PLGA) chứa gentamicin sử dụng trong các băng vết thương thông minh có hoạt tính kháng khuẩn mạnh.
Triển vọng và thách thức
Vật liệu nano hoạt động có thể đẩy nhanh quá trình chữa lành vết thương dựa vào các đặc tính và tính chất độc đáo của những chúng. Một số đặc tính quan trọng của vật liệu nano ảnh hưởng đến quá trình lành vết thương: hoạt động kháng khuẩn; vận chuyển thuốc có kiểm soát; điều chỉnh tình trạng viêm; tăng cường sự tăng sinh và di chuyển của tế bào; thúc đẩy quá trình hình thành mạch máu; tái tạo ma trận ngoại bào; các tính chất vật lý và hóa học của vật liệu nano ảnh hưởng đến quá trình sản xuất và tổ chức của fibronectin (những glycoprotein trọng lượng phân tử lớn được tìm thấy trong huyết tương và môi trường ngoại bào) và elastin (một loại protein chịu trách nhiệm về độ đàn hồi và khả năng phục hồi của da, cho phép da căng ra và sau đó trở lại hình dạng ban đầu).
Mặc dù liệu pháp chữa lành vết thương dựa trên vật liệu nano có nhiều ưu điểm, nhưng vẫn còn một số thách thức cần được giải quyết. Các thách thức này bao gồm các mối quan ngại về độc tính, các cân nhắc về quy định, khả năng mở rộng sản xuất và tính ổn định lâu dài của vật liệu. Điều này cho thấy cần có nhiều nghiên cứu hơn nữa để tối ưu hóa thiết kế và công thức của vật liệu nano, hiểu được tương tác của chúng với các hệ thống sinh học và tiến hành các nghiên cứu tiền lâm sàng và lâm sàng nghiêm ngặt để đảm bảo tính an toàn và hiệu quả của vật liệu.
Dù còn nhiều thách thức, trong tương lai, các vật liệu nano có thể được thiết kế để giải phóng các yếu tố tăng trưởng, cytokine và các thành phần của ma trận ngoại bào, thúc đẩy sự tăng sinh tế bào, hình thành mạch máu và tái tạo mô để đẩy nhanh quá trình chữa lành vết thương. Vật liệu nano có thể được thiết kế để điều chỉnh phản ứng miễn dịch, giảm tình trạng viêm quá mức và thúc đẩy quá trình chữa lành cân bằng. Phương pháp này có thể có lợi cho các vết thương mãn tính và những vết thương có khả năng chữa lành kém. Việc tích hợp các cảm biến nano vào băng vết thương có thể theo dõi tiến trình chữa lành vết thương, phát hiện nhiễm trùng hoặc biến chứng theo thời gian thực và cho phép cá nhân hóa các phương pháp điều trị.
Một cách tóm lược, có thể thấy ứng dụng vật liệu nano trong chăm sóc vết thương là một bước tiến đáng kể trong lĩnh vực y sinh. Vật liệu nano đã cho phép phát triển các loại băng vết thương, khung và nhiều liệu pháp tiên tiến khác nhau nhờ các đặc điểm đặc biệt của chúng, chẳng hạn như các đặc điểm lý hóa có thể điều chỉnh và khả năng nhắm hướng mục tiêu cụ thể (tính hướng đích). Phạm vi ứng dụng tiềm năng rộng lớn của vật liệu nano trong việc điều trị cả vết thương cấp tính và mãn tính báo hiệu tương lai tốt đẹp cho việc chăm sóc vết thương. Sự kết hợp giữa công nghệ nano và y học cá nhân hóa có tiềm năng cá nhân hóa chăm sóc sức khỏe bằng cách giảm chi phí và cải thiện thời gian điều trị. Về cơ bản, vật liệu nano chắc chắn sẽ mở ra một kỷ nguyên mới về các phương pháp chữa lành vết thương hiệu quả, phù hợp với từng bệnh nhân và mang tính cách mạng hơn.
Tác giả: PGS.TS. Nguyễn Hoàng Nam, Trường ĐH Khoa học Tự nhiên – ĐHQG Hà Nội.
Biên tập: Quỹ Đổi mới sáng tạo Vingroup (VinIF).
Tài liệu tham khảo:
[1] T. Liu, Y. Lu, R. Zhan, W. Qian, G. Luo, Nanomaterials and nanomaterials-based drug delivery to promote cutaneous wound healing, Adv. Drug Deliv. Rev., 193 (2023), 10.1016/j.addr.2022.114670.
[2] M. Napagoda, P. Madhushanthi, S. Witharana, Nanomaterials for wound healing and tissue regeneration, Nanotechnology in Modern Medicine (2022), 10.1007/978-*******8050-3_5.
[3] Z. Xu, M. Dong, S. Yin, J. Dong, M. Zhang, R. Tian, W. Min, L. Zeng, H. Qiao, J. Chen, Why traditional herbal medicine promotes wound healing: research from immune response, wound microbiome to controlled delivery, Adv. Drug Deliv. Rev., 195 (2023), 10.1016/j.addr.2023.114764.
[4] F. Yang, X. Bai, X. Dai, Y. Li, The biological processes during wound healing, Regen. Med., 16 (2021), 10.2217/rme-2020-0066.
[5] S. Huan, L. Tay, Four curious cases of closed-incision negative pressure therapy (ciNPT), Cureus (2020), 10.7759/cureus.8193.
[6] A. Naskar, K.S. Kim, Recent advances in nanomaterial-based wound-healing therapeutics, Pharmaceutics, 12 (2020), 10.3390/pharmaceutics12060499.
[7] F.D. Pakpahan, I. Rahmiyani, Y.P. Sukmawan, Wound healing activity of the clitoria ternatea L. Flower ethanolic extract gel preparation in diabetic animal model, Res. J. Pharm. Technol., 16 (2023), pp. 140-144, 10.52711/0974-360X.2023.00026.
[8] R. Sharma, K.S. Sharma, D. Kumar, Introduction to Nanotechnology, Nanomaterials in Clinical Therapeutics: Synthesis and Applications (2022), 10.1002/9781119857747.ch1.
[9] N. Baig, I. Kammakakam, W. Falath, I. Kammakakam, Nanomaterials: a review of synthesis methods, properties, recent progress, and challenges, Mater Adv, 2 (2021), 10.1039/d0ma00807a.
[10] N. Bhardwaj, D. Chouhan, B.B. Mandal, Tissue engineered skin and wound healing: current strategies and future directions, Curr. Pharmaceut. Des., 23 (2017), 10.2174/1381612823666170526094606.
[11] W. Wang, K.J. Lu, C.H. Yu, Q.L. Huang, Y.Z. Du, Nano-drug delivery systems in wound treatment and skin regeneration, J. Nanobiotechnol., 17 (2019), 10.1186/s12951-019-0514-y.
[12] U. Jana, S. Pal, G.P. Mohanta, P.K. Manna, R. Manavalan, Nanoparticles: a potential approach for drug delivery, Res. J. Pharm. Technol., 4 (2011).
[13] A.D. Juncos Bombin, N.J. Dunne, H.O. McCarthy, Electrospinning of natural polymers for the production of nanofibres for wound healing applications, Mater. Sci. Eng. C, 114 (2020), 10.1016/j.msec.2020.110994.
[14] S. Pal, D. Mehta, U. Dasgupta, A. Bajaj, Advances in engineering of low molecular weight hydrogels for chemotherapeutic applications, Biomed. Mater., 16 (2021), 10.1088/1748-605X/abdce1.
[15] T. Zhang, Y. Gao, W. Cui, Y. Li, D. Xiao, R. Zhou, Nanomaterials-based cell osteogenic differentiation and bone regeneration, Curr. Stem Cell Res. Ther., 16 (2020), 10.2174/1574888×15666200521083834.
[16] M.A. Ali, T. Ahmed, W. Wu, A. Hossain, R. Hafeez, M.M.I. Masum, Y. Wang, Q. An, G. Sun, B. Li, Advancements in plant and microbe-based synthesis of metallic nanoparticles and their antimicrobial activity against plant pathogens, Nanomaterials, 10 (2020), 10.3390/nano10061146.
[17] K.N. Thakkar, S.S. Mhatre, R.Y. Parikh, Biological synthesis of metallic nanoparticles, Nanomedicine, 6 (2010), 10.1016/j.nano.2009.07.002.
[18] E. Bellu, S. Medici, D. Coradduzza, S. Cruciani, E. Amler, M. Maioli, Nanomaterials in skin regeneration and rejuvenation, Int. J. Mol. Sci., 22 (2021), 10.3390/ijms22137095.
[19] A. Qadir, U. Ahmad, A. Ali, A. Shahid, Mohd Aqil, N. Khan, A. Ali, W.H. Almalki, S. Alghamdi, MdA. Barkat, S. Beg, Lipid engineered nanoparticle therapy for burn wound treatment, Curr. Pharmaceut. Biotechnol., 23 (2021), 10.2174/1389201022666210823110532.
[20] L. Degli Esposti, F. Carella, M. Iafisco, Inorganic nanoparticles for theranostic use, Electrofluidodynamic Technologies (EFDTs) for Biomaterials and Medical Devices: Principles and Advances (2018), 10.1016/B978-0-08-101745-6.00017-7.
[21] E. Abohamzeh, M. Sheikholeslami, A. Shafee, Toxicity of nanomaterials, Nanomaterials and Nanotechnology in Medicine (2022), 10.1002/9781119558026.ch17.
[22] Y. Liu, S. Song, S. Liu, X. Zhu, P. Wang, Application of nanomaterial in hydrogels related to wound healing, J. Nanomater., 2022 (2022), 10.1155/2022/4656037.
[23] J. Nandhini, E. Karthikeyan, S. Rajeshkumar, Nanomaterials for wound healing: Current status and futuristic frontier, Biomedical Technology 6 (2024), 26-45, 10.1016/j.bmt.2023.10.001.
[24] H. Sinno, S. Prakash, Complements and the wound healing cascade: an updated review Plast Surg Int, 2013 (2013), 10.1155/2013/146764.
[25] S.M. McCarty, S.L. Percival, Proteases and delayed wound healing, Adv. Wound Care, 2 (2013), 10.1089/wound.2012.0370.
[26] W.J. Martin, Tissue regeneration without scarring achieved by enhancing the alternative cellular energy (ACE) pathway, J. Chem. Dermatol. Sci. Appl., 7 (2017), 10.4236/jcdsa.2017.71009.
[27] P. Martin, R. Nunan, Cellular and molecular mechanisms of repair in acute and chronic wound healing, Br. J. Dermatol., 173 (2015), 10.1111/bjd.13954.
[28] P. Krzyszczyk, R. Schloss, A. Palmer, F. Berthiaume, The role of macrophages in acute and chronic wound healing and interventions to promote pro-wound healing phenotypes, Front. Physiol., 9 (2018), 10.3389/fphys.2018.00419.
[29] D.M. Cruz, E. Mostafavi, A. Vernet-Crua, H. Barabadi, V. Shah, J.L. Cholula-Díaz, G. Guisbiers, T.J. Webster, Green nanotechnology-based zinc oxide (ZnO) nanomaterials for biomedical applications: a review, JPhys Materials, 3 (2020), 10.1088/2515-7639/ab8186.
[30] I. Pastar, O. Stojadinovic, N.C. Yin, H. Ramirez, A.G. Nusbaum, A. Sawaya, S.B. Patel, L. Khalid, R.R. Isseroff, M. Tomic-Canic, Epithelialization in wound healing: a comprehensive review, Adv. Wound Care, 3 (2014), 10.1089/wound.2013.0473.
[31] M.M. Mihai, M. Preda, I. Lungu, M.C. Gestal, M.I. Popa, A.M. Holban, Nanocoatings for chronic wound repair—modulation of microbial colonization and biofilm formation, Int. J. Mol. Sci., 19 (2018), 10.3390/ijms19041179.
[32] M.K. Iqubal, S. Saleem, A. Iqubal, A. Chaudhuri, F.H. Pottoo, J. Ali, S. Baboota, Natural, synthetic and their combinatorial nanocarriers based drug delivery system in the treatment paradigm for wound healing via dermal targeting, Curr. Pharmaceut. Des., 26 (2020), 10.2174/1381612826666200612164511.
[33] A.E. Stoica, C. Chircov, A.M. Grumezescu, Nanomaterials for wound dressings: an Up-to-Date overview, Molecules, 25 (2020), 10.3390/molecules25112699.
[34] A. Barroso, H. Mestre, A. Ascenso, S. Simões, C. Reis, Nanomaterials in wound healing: from material sciences to wound healing applications,Nano Select., 1 (2020), 10.1002/nano.202000055.

