Suy giảm chức năng sinh sản hoặc nội tiết được coi là một vấn đề sức khỏe đáng báo động toàn cầu. Theo tổ chức y tế thế giới (WHO), ước tính có khoảng 186 triệu phụ nữ đã từng kết hôn, trong độ tuổi sinh sản, ở các nước đang phát triển (chưa tính Trung Quốc) đối mặt với vấn đề vô sinh do nhiều nguyên nhân. Với mong muốn đem lại niềm hạnh phúc cho các cặp vợ chồng vô sinh hiếm muộn, giảm tải gánh nặng xã hội, các kỹ thuật hỗ trợ sinh sản (ARTs – Assisted Reproductive Technologies) đã ra đời, trong đó trứng và phôi được thao tác và xử lý bên trong phòng thí nghiệm. Những nghiên cứu về ARTs đã đạt được nhiều thành tựu đáng kể, tạo ra những “em bé ống nghiệm”.
Cùng nhìn lại về năm 1895, công nghệ cấy ghép buồng trứng được giới thiệu như một khởi đầu đầy hứa hẹn của những nghiên cứu về ARTs [1]. Và hơn sau một thế kỷ, các kỹ thuật ARTs được phát triển, tối ưu, thực hiện thành công trên nhiều ca khó, có thể kể đến như: ca cấy ghép tử cung người đầu tiên vào năm 1931 [2, 3], ca sinh từ phương pháp thụ tinh trong ống nghiệm (IVF – In Vitro Fertilization) đầu tiên vào năm 1978 [4], và khả năng sinh con từ phôi đông lạnh vào năm 1984 [5]. Dù đạt được nhiều thành tựu đáng kể, những nghiên cứu trên hệ sinh sản nữ cũng gặp nhiều rào cản to lớn, bao gồm những lo ngại về đạo đức cho sức khoẻ mẹ và em bé khi thử nghiệm các kỹ thuật và thuốc thử mới. Mô hình động vật có thể được thay thế trong nghiên cứu, tuy nhiên không thể tái tạo hoàn toàn môi trường trong cơ thể người do những sai khác vốn có giữa các loài. Do đó, nhu cầu phát triển những mô hình nghiên cứu tái tạo vi môi trường trong cơ thể người mẹ là vô cùng cấp thiết.

Những công nghệ tiên tiến hiện nay, có thể kể đến như kỹ thuật mô, “chip nội tạng” (organ-on-chip – OoC), trí tuệ nhân tạo, công nghệ chỉnh sửa gen (CRISPR-Cas 9) và kỹ thuật hình ảnh có tiềm năng tạo nên những đột phá lớn trong hỗ trợ sinh sản nữ. Bài viết này khái quát những thành tựu gần đây cũng như bàn về những tiềm năng, thách thức của những kỹ thuật trên trong ARTs.
Kỹ thuật mô tạo cấu trúc mô nhân tạo cho phép tái tạo mô trong cơ thể người
Mô 3D có thể được sử dụng để tạo ra các môi trường nuôi cấy phôi giống như trong cơ thể người [6]. Điều này giúp tăng tỷ lệ thành công của quá trình IVF và cung cấp một môi trường lý tưởng cho sự phát triển của phôi. Kết quả nghiên cứu gần đây được các nhà khoa học công bố trên tạp chí Cell cho thấy tiềm năng của nền tảng mô 3D cho phép nuôi cấy phôi khỉ đến 25 ngày sau khi thụ tinh, cho phép quan sát những đặc điểm sớm của quá trình hình thành hệ thần kinh [7]. Đây là khoảng thời gian nuôi cấy phôi bên ngoài cơ thể dài nhất tính đến nay. Mặc dù mới là những kết quả bước đầu, hệ thống trên đã mở ra hướng nghiên cứu tái tạo mô trong cơ thể người mẹ cho phát triển phôi, kết hợp với hệ thống “tử cung nhân tạo” để nuôi phôi ở nhiều giai đoạn phát triển khác nhau [8]. Trong nuôi cấy trứng trong phòng thí nghiệm, mô hình nuôi cấy 3D bảo tồn hình thái và duy trì sự phát triển của nang trứng. Điều thú vị là, các tương tác tế bào – tế bào và ma trận tế bào được hỗ trợ bởi các giá thể cho những kết quả cải thiện về mặt hình thái tế bào, sự trưởng thành của nhân, sự phát triển của noãn bào, tỷ lệ thụ tinh và chất lượng phôi [9, 10].
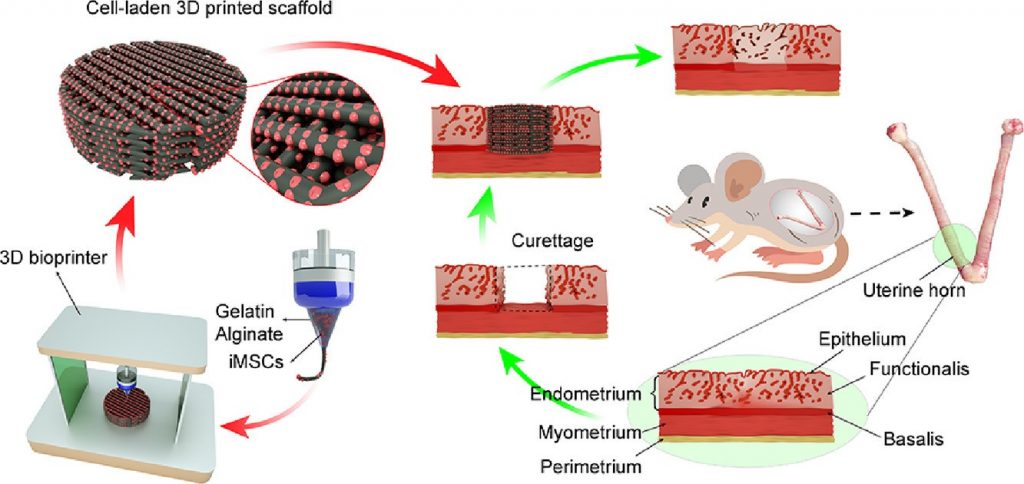
Kỹ thuật in 3D cho phép tạo ra các mô và cơ quan sinh sản nhân tạo có thể được sử dụng để cấy ghép cho những bệnh nhân bị tổn thương hoặc thiếu hụt chức năng sinh sản. Đây là một bước tiến lớn trong việc khắc phục vô sinh và các vấn đề liên quan đến sinh sản. Các nhà khoa học của phòng thí nghiệm sinh học sinh sản ở Bệnh viện Đại học Copenhagen Rigshospitalet (Đan Mạch) đã lần đầu giới thiệu thử nghiệm phát triển buồng trứng nhân tạo này tại một hội thảo được tổ chức ở Barcelona (Tây Ban Nha). Buồng trứng nhân tạo được chế tạo từ mô buồng trứng thật của bệnh nhân, có thể được cấy ghép vào cơ thể họ và sau đó vẫn có thể sản sinh ra trứng một cách tự nhiên vào mỗi tháng. Kỹ thuật đột phá này được phát triển để giúp các phụ nữ và những cô gái có nguy cơ bị vô sinh do quá trình điều trị ung thư gây ra. Chẳng hạn, thuốc hóa trị có nguy cơ gây vô sinh cho bệnh nhân nữ vì chúng có thể phá hủy buồng trứng. Trong một nghiên cứu khác, Kniazeva và cộng sự đã cấy ghép nang trứng được bao bọc trong vật liệu sinh học 3D vào trong cơ thể chuột vô sinh. Chuột đã tiếp tục các chu trình sinh sản sau khi được cấy ghép [11]. Và kết quả bất ngờ đã xuất hiện: khi sử dụng vật liệu sinh học thích hợp, chuột có khả năng sinh con non. Bên cạnh buồng trứng nhân tạo, một số nghiên cứu đã phát triển tử cung nhân tạo để cấy ghép cho những bệnh nhân tổn thương. Những nghiên cứu đã được thực hiện bước đầu trên động vật và thu được nhiều kết quả khả quan.
Công nghệ kênh dẫn vi lưu (microfluidics) cho phép chế tạo chip nội tạng (OoC)
Được các nhà nghiên cứu tại đại học Havard phát triển với khả năng nuôi cấy tế bào sống trong một cấu trúc cỡ micro, tái tạo lại vi môi trường trong cơ thể người, OoC đã đoạt được giải thưởng “Thiết kế của năm 2015” do Viện Bảo tàng Thiết kế Luân Đôn (Anh) tổ chức. Không chỉ tái tạo vi môi trường ở cấp độ mô, OoC được các nhà khoa học chế tạo từ vật liệu polyme trong suốt, được tạo sẵn nhiều vi kênh nhỏ chứa các tế bào sống mà thông qua đó không khí, chất dinh dưỡng, máu và vi khuẩn gây nhiễm trùng được bơm vào để mô phỏng các cơ quan nội tạng người [12-16]. Với những nghiên cứu về hệ sinh sản, chu trình hooc-mon cũng như các tác động cơ học lên tế bào đóng vai trò then chốt. Công nghệ OoC cho phép mô phỏng nhân tạo những yếu tố đó, kết hợp với nền tảng cảm biến sinh học cho phép theo dõi sự phát triển của trứng, phôi trong các quy trình ARTs.
Ferraz và cộng sự đã giới thiệu “ống dẫn trứng trên chip” (oviduct-on-chip) để tăng cường sự phát triển và biệt hóa tế bào trong môi trường nuôi cấy động trong kênh dẫn vi lưu [17]. Ống dẫn trứng nhân tạo trải qua những thay đổi hooc-mon tuần hoàn trong thời kỳ quanh rụng trứng, điều này rất quan trọng cho sự phát triển của tế bào biểu mô ống dẫn trứng và sự phát triển của phôi. Yếu tố này được tích hợp vào thiết bị ống dẫn trứng trên chip để hỗ trợ tái tạo các điều kiện sinh lý tốt hơn so với trong phương pháp IVF thông thường. Kết quả nghiên cứu được công bố trên tạp chí Nature, cho thấy hợp tử phát triển trong hệ thống trên có biểu hiện gen giống với hợp tử phát triển trong cơ thể.
Gần đây, các nhà khoa học và kỹ sư y sinh đã phát triển hệ thống nằm gọn trong bàn tay có tên là EVATAR, nhằm tái tạo chu kỳ hooc-mon 28 ngày của phụ nữ bao gồm các giai đoạn phát triển nang trứng, rụng trứng, và giai đoạn hoàng thể [19]. Hệ thống này cho phép các nhà nghiên cứu quan sát và hiểu rõ hơn về các quá trình sinh học phức tạp liên quan đến chu kỳ kinh nguyệt của phụ nữ. Hệ thống này bao gồm các mô hình 3D của buồng trứng, tử cung, cổ tử cung và các mô liên quan khác. Các mô hình này được kết nối với nhau và được điều khiển bằng các hooc-mon tương tự như trong cơ thể con người, giúp tạo ra một môi trường sinh học chân thực, từ đó giúp nghiên cứu y học và dược phẩm trong lĩnh vực sinh sản.
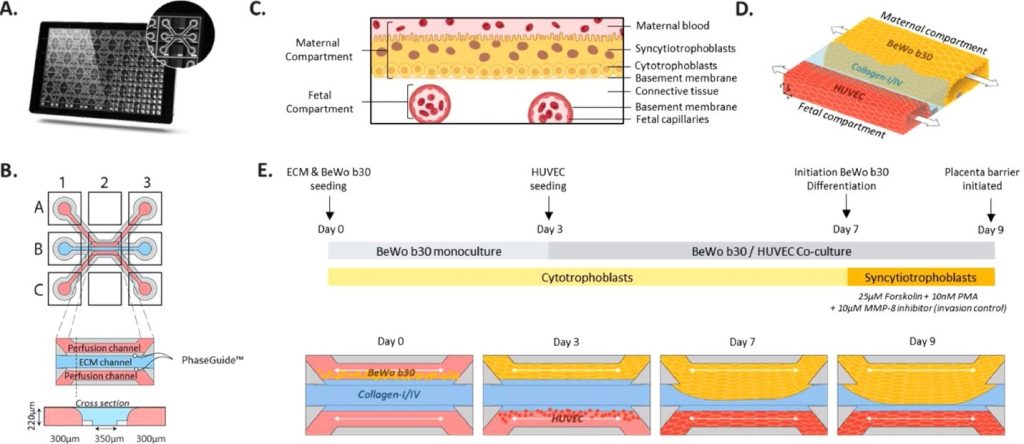
Công nghệ OoC cũng cho phép tái tạo hàng rào nhau thai của con người trong môi trường phòng thí nghiệm (Hình 3, Placental barrier-on-a-chip) [20, 21]. Công nghệ này mang lại nhiều tiềm năng trong nghiên cứu y học, đặc biệt là nghiên cứu về sức khỏe thai kỳ và các bệnh lý liên quan đến nhau thai. Hệ thống này tái tạo một cách chính xác cấu trúc và chức năng của hàng rào nhau thai, bao gồm các lớp tế bào khác nhau như tế bào nội mô và tế bào nuôi. Điều này cho phép nghiên cứu các quá trình sinh lý diễn ra tại hàng rào nhau thai, bao gồm trao đổi chất dinh dưỡng, khí và chất thải giữa mẹ và thai nhi. Các nhà khoa học có thể thử nghiệm các tác động của các yếu tố ngoại lai như thuốc, hóa chất, và vi sinh vật lên nhau thai và thai nhi cũng như phát hiện các dấu hiệu bệnh lý như tiền sản giật, tiểu đường thai kỳ và các rối loạn liên quan đến nhau thai.
Những hệ thống trên cung cấp một giải pháp thay thế cho việc sử dụng động vật trong nghiên cứu, giảm thiểu các vấn đề đạo đức và tăng cường độ chính xác của các kết quả nghiên cứu liên quan đến hệ sinh sản con người.
Công nghệ chỉnh sửa gen và tiến bộ trong phòng/trị bệnh cho phôi giai đoạn sớm
Giải Nobel Hoá học 2020 được trao cho hai nhà khoa học nữ Pháp và Mỹ về công trình nghiên cứu chỉnh sửa gen CRISPR/Cas9, công nghệ quan trọng mở đầu cho kỷ nguyên mới của công nghệ sinh học. Công nghệ này mang lại tiềm năng to lớn trong việc điều trị các bệnh di truyền và cải thiện sức khỏe của thế hệ tương lai. CRISPR/Cas9 đóng vai trò như một “chiếc kéo di truyền”, là công cụ mạnh mẽ để điều trị các bệnh liên quan đến đột biến gen.
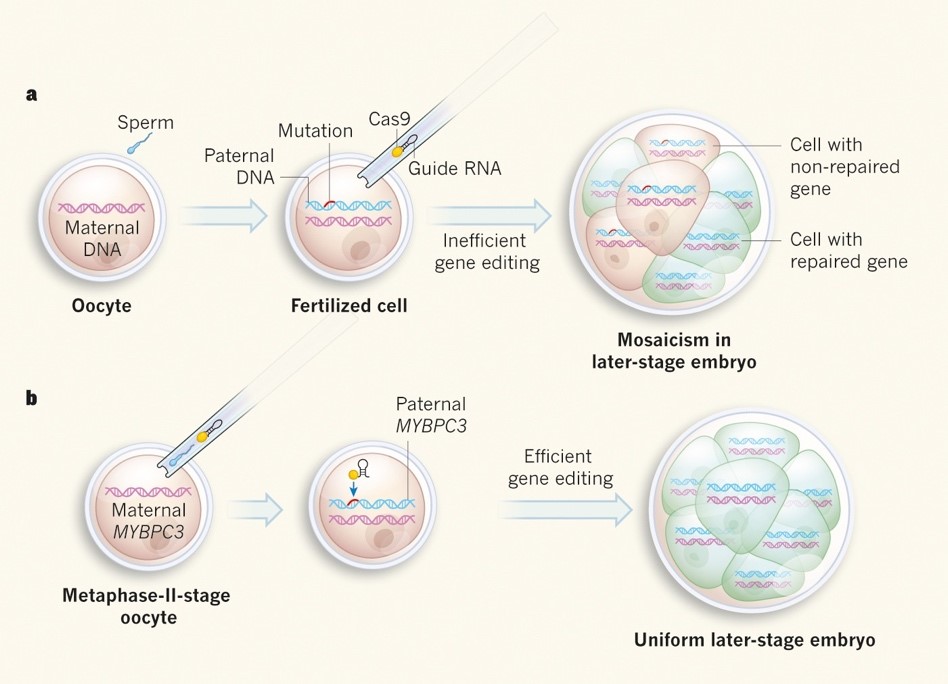
Trong quy trình tạo ra phôi bên ngoài cơ thể, phương pháp CRISPR/Cas9 có thể được sử dụng để chỉnh sửa gen không mong muốn và cấy lại vào cơ thể người mẹ. Tiềm năng của CRISPR/Cas9 trong lĩnh vực hỗ trợ sinh sản là vô cùng to lớn. CRISPR-Cas9 có tiềm năng được sử dụng để sửa chữa hoặc loại bỏ các gen gây bệnh trong phôi, ngăn ngừa các bệnh di truyền như xơ nang, bệnh Huntington, bệnh máu khó đông. Công nghệ này cung cấp một công cụ mạnh mẽ để nghiên cứu các quá trình sinh học cơ bản và phát triển các phương pháp điều trị mới.
Việc ứng dụng CRISPR/Cas9 trong chỉnh sửa gen cho phôi giai đoạn sớm đã đạt được những kết quả bước đầu tiềm năng. Các nhà khoa học mới đây đã công bố kết quả nghiên cứu trên tạp chí Nature, sử dụng công nghệ chỉnh gen cho đột biến MYBPC3 gây ra bệnh cơ tim trong phôi trước khi làm tổ ở người [22]. Nghiên cứu đạt được các kết quả khả quan, cho thấy bằng chứng về những chỉnh sửa phù hợp và loại bỏ những tác hại không mong muốn. Tuy nhiên, những nghiên cứu sử dụng CRISPR/Cas9 với phôi người thì chắc chắn cần thêm nhiều bằng chứng thuyết phục hơn nữa trước khi có thể ứng dụng lâm sàng. Thêm vào đó, nhiều người cũng e ngại về việc tạo ra những em bé siêu nhân “designer babies” từ công nghệ này. Tại thời điểm này, chỉnh sửa gen ở phôi người vẫn đặc biệt nguy hiểm. He Jiankui, người tạo ra những đứa trẻ CRISPR đầu tiên ở Trung Quốc vào năm 2018, đã bị kết án tù 3 năm vì vô trách nhiệm về mặt đạo đức. Tuy nhiên, việc điều chỉnh đột biến gây bệnh bằng kỹ thuật CRISPR/Cas9 có thể mang lại lợi thế lớn và sẽ tiếp tục là chủ đề rất được quan tâm trong cộng đồng khoa học trong tương lai [23].
Công nghệ hình ảnh time-lapse và kho dữ liệu hình ảnh khổng lồ thu được cho việc sử dụng AI trong lựa chọn giao tử/hợp tử
Bởi vì hầu hết các tiêu chí đánh giá giao tử (trứng, tinh trùng) và phôi đều dựa trên các đặc điểm hình thái, nên việc theo dõi tế bào trứng và phôi theo thời gian thực và liên tục là rất quan trọng trong các quy trình ART. Với các phương pháp ART truyền thống, trứng/phôi chỉ được quan sát tại một số thời điểm nhất định bên ngoài tủ nuôi, dưới kính hiển vi, có thể dẫn đến sự mất ổn định của môi trường nuôi cấy. Time-lapse là một kỹ thuật chụp ảnh theo chuỗi, ghi lại hình ảnh của phôi liên tục trong một khoảng thời gian nhất định. Những hình ảnh này sau đó được kết hợp lại để tạo thành một đoạn video, cho phép các nhà phôi học theo dõi sự phát triển của phôi một cách chi tiết và liên tục mà không cần phải lấy phôi ra khỏi tủ nuôi cấy, tăng khả năng thành công của quy trình IVF. Không chỉ giúp các nhà phôi học đánh giá toàn bộ quá trình phát triển của phôi, hệ thống time-lapse còn cung cấp bộ dữ liệu lớn cho các thuật toán trí tuệ nhân tạo để phân tích từng chất lượng phôi một cách tự động, tiết kiệm thời gian, độ chính xác cao và có tiềm năng phát hiện những chỉ dấu sinh học mới.
Trí tuệ nhân tạo (AI) là lĩnh vực có thể hỗ trợ việc phân tích các đặc điểm sinh học một cách nhanh chóng và chính xác, mang lại nhiều lợi ích cho các chuyên gia y tế và bệnh nhân trong lựa chọn giao tử và hợp tử. AI có thể phân tích hình ảnh của trứng để đánh giá chất lượng dựa trên các tiêu chí như hình dạng, kích thước, và cấu trúc màng tế bào. Các thuật toán AI được huấn luyện để nhận diện các đặc điểm của trứng khỏe mạnh và có tiềm năng thụ tinh cao. Bên cạnh đó, AI giúp phân loại tinh trùng dựa trên mức độ di động của chúng, từ đó xác định tinh trùng nào có khả năng thụ tinh cao nhất với độ chính xác lên đến trên 90% [24, 25]. Các thuật toán AI có thể phát hiện các trứng, tinh trùng bất thường về hình dạng và chức năng, giúp tăng cơ hội thụ tinh thành công.
Một số kết quả nghiên cứu gần đây cho thấy tiềm năng to lớn của AI, có thể thay các bác sĩ trong chuẩn đoán với độ chính xác cao hơn. Các mô hình AI đã được phát triển để đánh giá chất lượng phôi một cách tự động và nhanh chóng ở nhiều giai đoạn như tiền nhân, phôi phân chia và phôi nang. Không chỉ đánh giá về mặt hình thái, AI còn là một công cụ mạnh mẽ, không xâm lấn, giúp sàng lọc phôi lệch bội chỉ dựa trên hình ảnh. Với việc tích hợp các thuật toán học sâu để phân tích hình ảnh phôi được chụp bằng các kỹ thuật như time-lapse hoặc kính hiển vi kỹ thuật số, các thuật toán AI được huấn luyện để nhận diện các đặc điểm hình thái học của phôi lệch bội, như sự phân chia tế bào không đều, hình dạng bất thường của tế bào, và các dấu hiệu khác của bất thường nhiễm sắc thể, dự đoán khả năng phôi bị lệch bội với độ chính xác cao lên đến trên 70% chỉ trong thời gian không đến 25s cho bốn phôi [26]. Bên cạnh chất lượng noãn và phôi, còn có một số yếu tố khác như điều kiện phòng thí nghiệm và thao tác của các bác sĩ có thể tác động đáng kể đến kết quả điều điều trị vô sinh. Để có thể dự đoán tốt nhất về kết quả điều trị cuối cùng, những yếu tố này cần được xem xét trong các mô hình dự đoán. Tuy nhiên, việc sử dụng các thuật toán AI trong lâm sàng hiện còn một số hạn chế do thiếu tính chuẩn hóa và sự chuyển hoá cơ sở vật chất phù hợp để triển khai công nghệ tại các bệnh viện.
Cơ hội và thách thức
Mặc dù đã đạt được những thành tựu đáng kể, vẫn còn một số thách thức lớn trước khi tích hợp tất cả các công nghệ tiên tiến này vào hệ thống hỗ trợ sinh sản để phát triển phôi khỏe mạnh. Nghiên cứu về noãn bào người và đặc biệt là phôi thai làm dấy lên các câu hỏi đạo đức về việc ai sẽ có quyền tiếp cận những công nghệ này. Thêm vào đó, cần thực hiện thêm rất nhiều nghiên cứu, thử nghiệm để có thể đạt được những quy trình chuẩn hoá cho việc ứng dụng những công nghệ này trong thực tiễn. Và cuối cùng, làm thế nào để có thể ứng dụng kết hợp tất cả các kỹ thuật tiên tiến trong một hệ thống hỗ trợ sinh sản vẫn còn là một thách thức lớn.
Các kỹ thuật mới bao gồm kỹ thuật mô, OoC, công cụ chỉnh sửa gen, time-lapse và AI đã thể hiện tiềm năng to lớn trong việc cách mạng hóa cách các quy trình hỗ trợ sinh sản: đánh giá và lựa chọn phôi tốt nhất, phát triển phôi bên ngoài cơ thể cho đến khi con non được sinh ra. Một hệ thống toàn diện kết hợp tất cả các kỹ thuật nêu trên hứa hẹn sẽ tạo nên những đột phá trong lĩnh vực điều trị sinh sản. Tuy nhiên, để điều này trở thành hiện thực, có một số thách thức lớn cần phải đối mặt. Để thu hẹp khoảng cách này, cần phải tiến hành nhiều nghiên cứu sâu rộng hơn nữa để đảm bảo hiệu quả các kỹ thuật này trước khi được sử dụng trong thực tiễn. Trong tương lai, mỗi bệnh nhân có thể được điều trị với phương pháp điều trị chính xác, với những phôi chất lượng cao có thể phát triển trong một môi trường tái tạo “cá nhân hóa” với hệ thống giám sát và đánh giá tự động. Những em bé khỏe mạnh sẽ được sinh ra với những tác động ít có hại nhất đến cơ thể mẹ.
Tác giả: TS. Đỗ Quang Lộc, Trường ĐH Khoa học Tự nhiên – ĐH Quốc gia Hà Nội.
Biên tập: Quỹ đổi mới sáng tạo Vingroup (VinIF).
Tài liệu tham khảo
1. Gosden RG (2010) Robert T. Morris, M.D. – Appreciation of an enlightened surgeon and pioneer of ovarian transplantation. Fertil Steril 94:1960–1963. https://doi.org/10.1016/j.fertnstert.2010.01.045
2. Gargus ES, Rogers HB, McKinnon KE, et al (2020) Engineered reproductive tissues. Nat Biomed Eng 4:381–393. https://doi.org/10.1038/s41551-020-0525-x
3. Favre-Inhofer A, Rafii A, Carbonnel M, et al (2018) Uterine transplantation: Review in human research. J Gynecol Obstet Hum Reprod 47:213–221. https://doi.org/10.1016/j.jogoh.2018.03.006
4. Steptoe PC, Edwards RG (1978) Birth after the reimplantation of a human embryo. Lancet 2:366. https://doi.org/10.1016/s0140-6736(78)92957-4
5. Zeilmaker GH, Alberda AT, van Gent I, et al (1984) Two pregnancies following transfer of intact frozen-thawed embryos. Fertil Steril 42:293–296. https://doi.org/10.1016/S0015-0282(16)48029-5
6. Govindasamy N, Long H, Jeong HW, et al (2021) 3D biomimetic platform reveals the first interactions of the embryo and the maternal blood vessels. Dev Cell 56:3276-3287.e8. https://doi.org/10.1016/J.DEVCEL.2021.10.014
7. Zhai J, Xu Y, Guo F, et al (2023) Neurulation of the cynomolgus monkey embryo achieved from 3D blastocyst culture. Cell 186:2078-2091.e18. https://doi.org/10.1016/j.cell.2023.04.019
8. Segers S (2021) The path toward ectogenesis: looking beyond the technical challenges. BMC Med Ethics 2021 221 22:1–15. https://doi.org/10.1186/S12910-021-00630-6
9. Kreeger PK, Deck JW, Woodruff TK, Shea LD (2006) The in vitro regulation of ovarian follicle development using alginate-extracellular matrix gels. Biomaterials 27:714–723. https://doi.org/10.1016/J.BIOMATERIALS.2005.06.016
10. Ji W, Hou B, Lin W, et al (2020) 3D Bioprinting a human iPSC-derived MSC-loaded scaffold for repair of the uterine endometrium. Acta Biomater 116:268–284. https://doi.org/10.1016/J.ACTBIO.2020.09.012
11. Kniazeva E, Hardy AN, Boukaidi SA, et al (2015) Primordial Follicle Transplantation within Designer Biomaterial Grafts Produce Live Births in a Mouse Infertility Model. Sci Rep 5:1–11. https://doi.org/10.1038/srep17709
12. Fernandes AC, Gernaey K V., Krühne U (2018) “Connecting worlds – a view on microfluidics for a wider application.” Biotechnol Adv 36:1341–1366. https://doi.org/10.1016/J.BIOTECHADV.2018.05.001
13. Ma C, Peng Y, Li H, Chen W (2021) Organ-on-a-Chip: A New Paradigm for Drug Development. Trends Pharmacol Sci 42:119–133. https://doi.org/10.1016/j.tips.2020.11.009
14. Ingber DE (2022) Human organs-on-chips for disease modelling, drug development and personalized medicine. Nat Rev Genet 23:467–491. https://doi.org/10.1038/s41576-022-00466-9
15. Leung CM, de Haan P, Ronaldson-Bouchard K, et al (2022) A guide to the organ-on-a-chip. Nat Rev Methods Prim 2022 21 2:1–29. https://doi.org/10.1038/s43586-022-00118-6
16. Young RE, Huh DD (2021) Organ-on-a-chip technology for the study of the female reproductive system. Adv Drug Deliv Rev 173:461–478. https://doi.org/10.1016/j.addr.2021.03.010
17. Ferraz MAMM, Rho HS, Hemerich D, et al (2018) An oviduct-on-a-chip provides an enhanced in vitro environment for zygote genome reprogramming. Nat Commun 9:. https://doi.org/10.1038/s41467-018-07119-8
18. Rabussier G, Bünter I, Bouwhuis J, et al (2023) Healthy and diseased placental barrier on-a-chip models suitable for standardized studies. Acta Biomater 164:363–376. https://doi.org/10.1016/J.ACTBIO.2023.04.033
19. Xiao S, Coppeta JR, Rogers HB, et al (2017) A microfluidic culture model of the human reproductive tract and 28-day menstrual cycle. Nat Commun 8:1–13. https://doi.org/10.1038/ncomms14584
20. Yin F, Zhu Y, Zhang M, et al (2019) A 3D human placenta-on-a-chip model to probe nanoparticle exposure at the placental barrier. Toxicol Vitr 54:105–113. https://doi.org/10.1016/j.tiv.2018.08.014
21. Zhu Y, Yin F, Wang H, et al (2018) Placental Barrier-on-a-Chip: Modeling Placental Inflammatory Responses to Bacterial Infection. ACS Biomater Sci Eng 4:3356–3363. https://doi.org/10.1021/acsbiomaterials.8b00653
22. Ma H, Marti-Gutierrez N, Park SW, et al (2017) Correction of a pathogenic gene mutation in human embryos. Nat 2017 5487668 548:413–419. https://doi.org/10.1038/nature23305
23. Winblad N, Lanner F (2017) At the heart of gene edits in human embryos. Nat 2017 5487668 548:398–400. https://doi.org/10.1038/nature23533
24. Javadi S, Mirroshandel SA (2019) A novel deep learning method for automatic assessment of human sperm images. Comput Biol Med 109:182–194. https://doi.org/10.1016/J.COMPBIOMED.2019.04.030
25. Thirumalaraju P, Kanakasabapathy MK, Bormann CL, et al (2019) Human sperm morphology analysis using smartphone microscopy and deep learning. Fertil Steril 112:e41. https://doi.org/10.1016/j.fertnstert.2019.07.237
26. Chavez-Badiola A, Flores-Saiffe-Farías A, Mendizabal-Ruiz G, et al (2020) Embryo Ranking Intelligent Classification Algorithm (ERICA): artificial intelligence clinical assistant predicting embryo ploidy and implantation. Reprod Biomed Online 41:585–593. https://doi.org/10.1016/j.rbmo.2020.07.003

